1月30日在《细胞研究》(Cell Research)杂志上发表了一项具有里程碑意义的研究,报道了对孤儿G蛋白偶联受体GPR3的内源性激动剂的结构和功能特征的揭示。GPR3是一种广泛表达于大脑区域(包括下丘脑、海马体和皮层)以及肝脏和卵巢等周围组织中的A类孤儿G蛋白偶联受体(GPCR)。此前的研究强调了GPR3在调控多种生理功能中的关键作用,如神经突触/神经元存活、神经病理性疼痛和卵母细胞成熟。

GPR3与阿尔茨海默病的关联阿尔茨海默病(AD)小鼠模型的体内研究表明GPR3可以调节γ-分泌酶的活性,并介导淀粉样前体蛋白(APP)的淀粉样蛋白质水解。这一发现将GPR3定位为治疗AD的潜在治疗靶点。
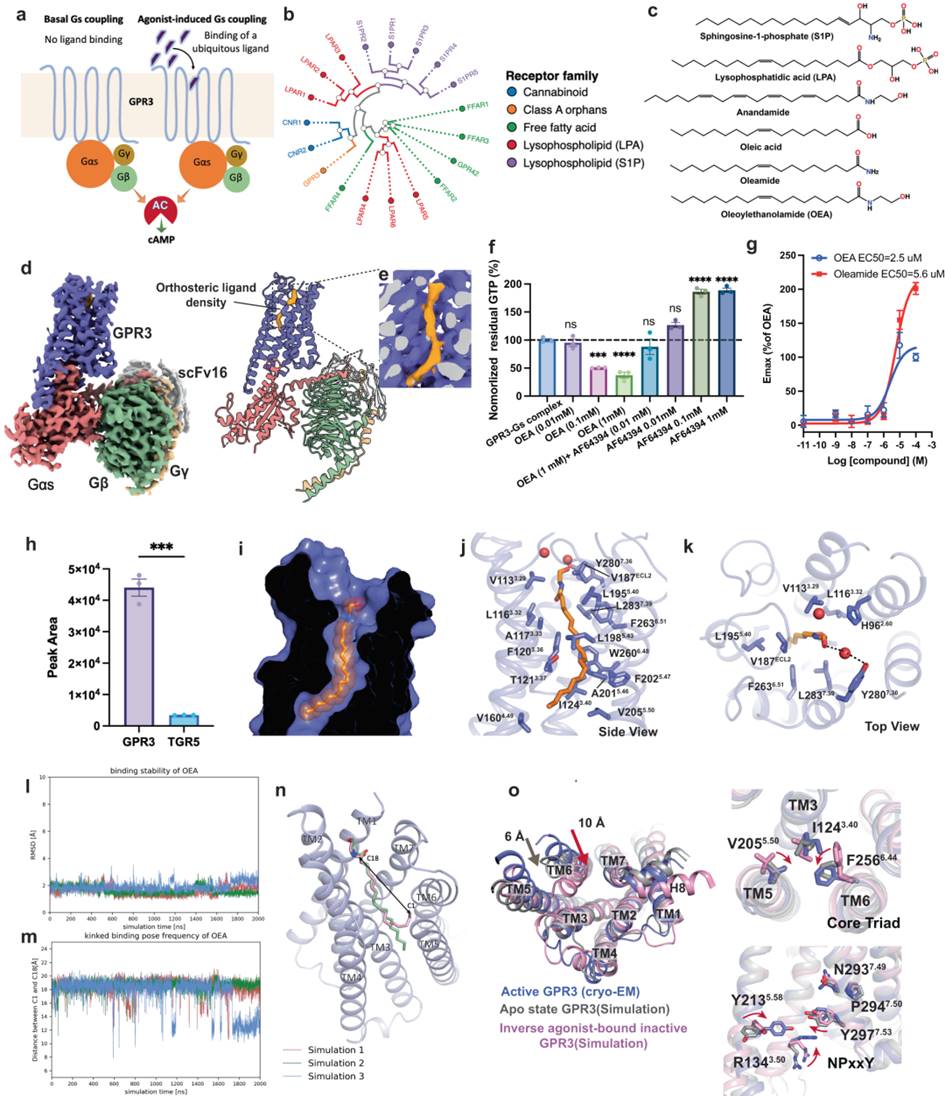
GPR3的结构和功能特性GPR3被描述为通过与异源三聚体Gs蛋白偶联来构成性地激活腺苷酸环化酶。它的构成性活性与自激活的孤儿受体GPR52相似,超过其他Gs偶联受体,如β2AR。研究发现,GPR3的高内在活性在响应寒冷诱导的脂肪分解中调节脂肪热产生中起着关键作用。
GPR3内源激动剂的结构和功能特征化(Credit: Cell research)
OEA与GPR3的结合
研究人员通过冷冻电镜(Cryo-EM)技术的帮助,揭示了在GPR3的正交位口中绑定的脂质样分子。此后,通过一系列实验,包括体外GTP转换试验和基于细胞的信号传导试验,识别出油酸乙醇胺(OEA)作为GPR3的潜在内源性激动剂。OEA在GTP转换试验中表现出显著的刺激效应,并且被先前报道的GPR3反向激动剂AF64394所拮抗。
OEA的作用机理接着,研究者们通过质谱(MS)分析,进一步证实了OEA作为GPR3内源性激动剂的可能性。他们还通过分子动力学(MD)模拟研究了OEA与GPR3的结合模式,并观察到OEA在模拟时间内保持相对稳定的构象。这些结果与OEA与GPR3相对弱的相互作用相符。
GPR3的激活机制和信号传导此外,研究团队还进行了基于Cryo-EM结构的MD模拟,以洞察GPR3在激动剂结合和G蛋白偶联时的构象转变。这些发现为揭示GPR3的信号传导机制提供了关键的结构基础,并为未来基于结构的GPR3小分子药物的发现提供了宝贵的模板。
研究中获得的3D冷冻电镜密度图已存储在电子显微镜数据库中(Electron Microscopy Data Bank),存取码为EMD-38015。OEA结合的GPR3–Gs–scFV16复合体的原子模型已存储在蛋白质数据库中(Protein Data Bank),存取码为8X2K。
原文链接
https://www.nature.com/articles/s41422-023-00919-8













